Fumare senza un fuoco sotto un microscopio virtuale con ingrandimento pari a 100,000,000x
A proposito di un vecchio trucco chimico su come spostare il fumo da un angolo di una stanza ad un altro. Sveleremo il segreto e spiegheremo la reazione chimica di questo trucco impiegando un microscopio virtuale ad ingrandimento pari a 100,000,000x. Ed infine, i nostri pensieri su perchè abbiamo scelto questo esperimento chimico per il nostro primo
C’è un vecchio trucco chimico: soffiare il fumo di una sigaretta in un bicchiere e capovolgerlo. Allo stesso tempo girare un altro bicchiere nell’angolo opposto della stanza. Il fumo si dirigerà dal primo bicchiere lungo la stanza per finire nel secondo. Ho cercato di farlo questo fine settimana passando una buona mezz’oretta a tossire dopo aver fatto un solo tiro di sigaretta. Ma come diavolo fate a fumare, gente? ;)

Allora, qual’è il segreto di questo trucco?
Andiamo al sodo e spieghiamolo subito. Non è che il fumo in modo magico vada da qualche parte. E’ solo che mentre il fumo della sigaretta si deposita nel primo bicchiere, un nuovo fumo si forma nel secondo. In questo caso si tratta di due tipi di gas – cloruro di idrogeno (il gas che una volta quando disciolto in acqua produce acido cloridrico) e ammoniaca (l’odore tipico dei barboni di strada). Mischiando questi due gas si produce un materiale solido chiamato cloruro di ammonio, chiamato cloruro di ammonio, le cui particelle noi vediamo come se si trattasse di fumo. Come avete potuto intuire, si tratta esattamente di ciò che è avvenuto nel secondo bicchiere: l’interno del bicchiere è stato ricoperto da una soluzione concentrata di acqua di cloruro di idrogeno (acido cloridrico), ed il tavolo sul quale è stato messo il bicchiere spruzzato con una soluzione concentrata di ammoniaca. Una volta messo il bicchiere sul tavolo, i vapori dei due gas hanno iniziato a mischiarsi generando fumo.

In ciò consiste il trucco. Ci sono diversi modi per impiegare l’effetto del fumo prodotto da questi due liquidi quando vengono messi vicini l’uno all’altro. Partiamo dal più semplice: prendete due bastoncini di cotone, immergeteli separatamente nei due liquidi e vedete quale sarà l’effetto se poi li metterete uno vicino all’altro. Oppure prendete due pipe fumanti ed impressionate il pubblico facendo vedere il flusso di fumo da una pipa all’altra.
Ma perchè abbiamo scelto proprio questo esperimento per il nostro primo video?
Inizialmente avevo stupidamente pensato che fosse opportuno iniziare bruciando l’idrogeno. Pensavo che si trattasse della reazione chimica più semplice: cosa ci può essere di più primitivo che un composto di ossigeno e dell’elemento maggiormente di base, l’idrogeno? Quanto sono stato sciocco ed ingenuo! Il mio ragionamento era: una molecola di O2 s avvicina ad una H2 molecola, esse entrano in contatto e se la velocità di collisione è superiore rispetto ad un determinata soglia (cioè se il gas è sufficientemente caldo), gli atomi si ricombinano nel modo quanto più efficiente possibile per andare a formare una molecola formata da H2O. Tuttavia questa non reazione si è rivelata così semplice come sembrava esserlo in un primo momento. Nel 1956 al chimico russo Nikolay Semenov ed al chimico fisico inglese Cyril Norman Hinshelwood è stato congiuntamente conferito il Premio Nobel per la Chimica per le loro ricerche nel meccanismo di queste reazioni chimiche.
Successivamente ho iniziato a prendere in considerazione le reazioni nelle soluzioni che producono precipitazioni. Anche le soluzioni basate sull’acqua non erano semplici. Gli ioni nell’acqua si muovono in qualità di particelle non libere, bensì in qualità di complesse strutture costituite da molecole di ionio e acqua fortemente collegate ad esso, il cosiddetto involucro solvatato. Il fatto in sè dimostra che le reazioni nelle soluzioni non sono così primitive come possono sembrare. Lasciamo da parte le reazioni complesse, seppur molto belle sui confini di fase, specialmente con un catalizzatore come questa o questa reazione.
Abbiamo voluto iniziare con un qualcosa di semplice, per cui abbiamo scelto questa reazione tra le tante che abbiamo sperimentato. Abbiamo pensato che la generazione del fumo durante una reazione di cloruro di idrogeno ed ammoniaca fosse il modo più semplice per comprendere e visualizzare le reazioni chimiche.
Il nostro primo video
Ci sono tanti bei video dedicati dalla microbiologia. Video che mostrano i processi dall’interno. Ecco alcuni esempi: trasferimento mRNA, replicazione DNA, dal DNA ad una proteina, in che modo il DNA è strutturato.
Tuttavia sono pochissimi i video dedicati alla chimica inorganica. Intendo dire non solamente video che si limitano a mostrare un bell’esperimento ma che mostrano soprattutto cosa avviene all’interno a livello molecolare. Attualmente perlomeno un video del genere c’è;) spero che in futuro ce ne possano essere di più.
Per cui, immaginiamoci di disporre di un microscopio che consente un ingrandimento pari a 100,000,000x. Si tratta dell’ingrandimento che ci serve per vedere gli atomi separati. Per cui prendiamo questo microscopio e diamo un’occhiata da vicino:
E’ stata la prima volta che ho deciso di condurre un esperimento con i miei figli durante il fine settimana e che sono riuscito a mostrare cosa stesse effettivamente accadendo all’interno. Ciò aiuta a comprendere la chimica meglio di qualsiasi altra formula. Iscrivetevi ai nostri aggiornamenti e seguiteci su Twitter per apprendere nuovi esperimenti chimici sotto il nostro microscopio virtuale.
Problema bonus
Ed ecco il nostro problema bonus di oggi: trovate gli errori in questo video. Ne abbiamo fatti parecchi, alcuni per ragioni artistiche, altri dovuti alla carenza di tempo. Siete in grado di trovarli? Twittateci le vostre risposte.
Vedere anche

Set di esperimento chimico sotto forma di sottoscrizione
Siamo finalmente pronti ad annunciare che aspetto avrà il nostro primo prodotto. Si tratterà del set di un esperimento chimico che potete impiegare a casa sebbene non si tratti di un set chimico tradizionale. Leggete quali sono i tre problemi che vediamo nei set chimici esistenti ed il modo in cui li risolviamo nel nostro set. Potete inoltre sottoscrivervi per essere informati su quando il prodotto viene rilasciato.
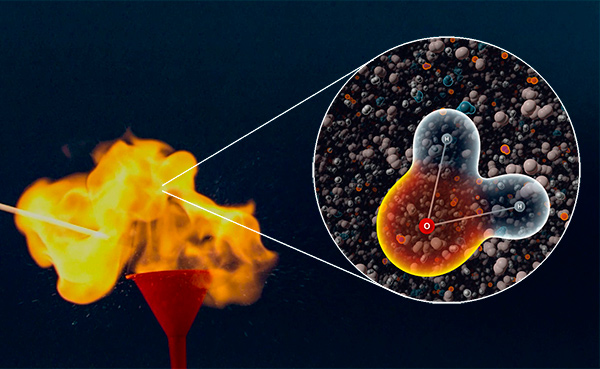
Segreti della combustione dell'idrogeno
Tutti conoscono la formula chimica dell'acqua: H2O. La maggior parte sarà in grado di scrivere l'equazione della reazione all'acquaо: 2H2 + O2 = 2H2O. Ma saranno pochissimi quelli in grado di spiegare in che modo questa reazione avviene in realtà. Vi presentiamo un video che spiega tutto.
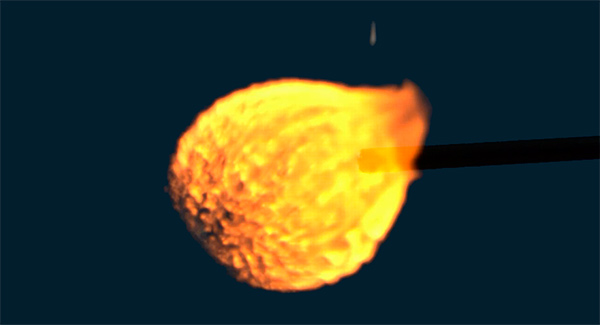
Esplosioni di bolle di idrogeno
Stiamo lavorando su un video che illustra il processo con il quale brucia l'idrogeno. Il video inizierà con l'esplosione di una bolla di idrogeno, per poi approfondire a livello molecolare, dove è possibile osservare molecole e atomi distinti e comprendere il processo con il quale brucia l'idrogeno. Durante la preparazione del video, abbiamo filmato un gran numero di esplosioni di bolle di idrogeno utilizzando una fotocamera ad alta velocità. Di seguito troverete una compilation delle migliori esplosioni. Buon divertimento! Dimenticatevi della scienza, e godetevi la bellezza ultraterrena del fuoco :)