De la fumée sans feu sous un microscope virtuel avec un grossissement x 100,000,000
À propos d’un vieux truc de chimie sur la manière de déplacer la fumée d’un coin à l’autre d’une pièce. Nous dévoilerons le secret et expliquerons la réaction chimique derrière ce truc au niveau moléculaire en utilisant un microscope virtuel avec un grossissement x 100,000,000. Et enfin nous en dirons un peu plus sur la raison du choix de cette expérience chimique pour notre première vidéo.
Il existe un vieux truc chimique : soufflez de la fumée de cigarette dans un verre et retournez-le. Au même moment, retournez un autre verre dans le coin opposé de la pièce. La fumée va voyager du premier verre à travers la pièce et apparaître dans le second verre. J’ai essayé de le faire ce week-end et j’ai passé une demi-heure à cracher mes poumons après une seule bouffée de cigarette. Comment faites-vous pour fumer, sérieusement ? ;)

Alors quel est le secret derrière ce truc ?
Allons droit au but et expliquons ce truc tout de suite. La fumée ne voyage pas par magie. C’est juste que tandis que la fumée de cigarette s’installe dans le premier verre, une nouvelle fumée se forme dans l’autre verre. Il y a deux gaz en action ici - du chlorure d’hydrogène (le gaz qui, lorsqu’il est dissout dans l’eau, produit de l’acide chlorhydrique) et de l’ammoniac (qui a cette odeur âcre et piquante). Lorsqu’ils sont mélangés ces deux gaz produisent un matériau solide appelé chlorure d’ammonium, les particules que l’on voit sous forme de fumée. Comme vous l’avez sans doute deviné, c’est exactement ce qui s’est passé dans le deuxième verre : l’intérieur du verre a été couvert d’une solution d’eau concentrée de chlorure d’hydrogène (acide chlorhydrique), et la table sur laquelle était posé le verre était recouverte d’une solution d’ammonia. Lorsque le verre a été posé sur la table, les vapeurs des deux gaz ont commencé à se mélanger et ont généré de la fumée.

Et voilà l’astuce. Il y a beaucoup de manières d’utiliser l’effet de la fumée produit par ces deux liquides lorsqu’ils sont suffisamment rapprochés. À commencer par le plus simple : prenez deux coton-tiges, imbibez-les d’un liquide correspondant et profitez de l’effet de génération de fumée en les rapprochant. Ou bien vous pouvez prendre deux pipes fumantes et impressionner le public en démontrant le flot de fumée d’une pipe à l’autre.
##Mais pourquoi avons-nous choisi cette expérience pour notre première vidéo ?
Initialement, je supposais bêtement que nous pourrions commencer avec de l’hydrogène se consumant. Je pensais qu’il s’agissait de la réaction chimique la plus simple : qu’y a-t-il de plus primitif qu’un composé d’oxygène et l’élément le plus basique - l’hydrogène ? Quelle naïveté ! Mon raisonnement était le suivant : une molécule d’O2 approche une molécule H2, elles se heurtent, et si la vitesse de collision est plus élevée qu’un seuil particulier (par ex. le gaz est assez chaud), les atomes se recombinent de la manière la plus efficace en termes d’énergie pour former une molécule de H2O. Mais cette réaction s’est avérée bien moins simple que prévu au départ. Le chimiste russe Nikolay Semenov et le chimiste physicien anglais Cyril Norman Hinshelwood ont été conjointement récompensés par le Prix Nobel de chimie en 1956 pour leurs recherches sur le mécanisme de ces réactions chimiques.
J’ai commencé alors à considérer les réactions en solution produisant des précipitations. Les réactions à base d’eau étaient également ardues. Les ions dans l’eau ne se déplacent pas en particules libres, mais comme des structures complexes composées d’un ion et de molécules d’eau attachées, appelée coquille solvate. Ce fait seul montre que les réactions dans les solutions ne sont pas aussi primitives qu’elles en ont l’air. À fortiori de belles, mais complexes réactions aux limites de la phase, en particulier avec un catalyseur comme cette ou cette réaction.
Nous voulions commencer avec quelque chose de simple, alors nous avons passé de nombreuses réactions chimiques et avons choisi celle-ci. Nous avons pensé que la génération de fumée au cours d’une réaction de chlorure d’hydrogène et d’ammonia était l’une des réactions chimiques les plus faciles à comprendre et visualiser.
Notre première vidéo
Il existe de nombreuses vidéos de qualité sur la microbiologie. Des vidéos qui montrent les processus de l’intérieur. Voici quelques exemples : La traduction de mRNA, une réplication d’ADN, de l’ADN à la protéine, comment l’ADN est conditionné.
Mais il n’existe à peu près aucune vidéo sur la chimie inorganique. Je ne veux pas parler de vidéos qui montrent simplement une belle expérience mais également ce qu’il se passe à l’intérieur au niveau moléculaire. Il existe au moins une telle vidéo ;) J’espère qu’il y en aura plus bientôt.
Alors imaginons que nous avons un microscope permettant un grossissement de x 100000000. C’est le genre de grossissement dont nous avons besoin pour voir les atomes séparés. Alors prenons ce microscope et regardons de plus près:
C’était la première fois que je menais des expériences avec mes enfants pendant un week-end et que je réussissais à leur montrer ce qu’il se passait réellement à l’intérieur. Cela aide à mieux comprendre la chimie plutôt qu’avec des formules. Abonnez-vous à nos mises à jour et suivez-nous sur Twitter pour en apprendre plus sur les nouvelles expériences chimiques sous notre microscope virtuel.
Problème bonus
Et voici notre problème bonus du jour : retrouvez les erreurs dans cette vidéo. Nous en avons fait plusieurs - certaines pour des raisons artistiques et d’autres, en raison du manque de temps. Saurez-vous les retrouver ? Twittez-nous vos réponses.
Voir également

Coffret expérimental de chimie par abonnement
Nous sommes enfin prêts à vous dévoiler à quoi ressemblera notre premier produit. Ce sera un coffret expérimental de chimie que vous pourrez utiliser à la maison. Mais il ne s’agit pas d’un coffret de chimie traditionnel. Lisez les trois problèmes que nous voyons dans les coffrets de chimie existants et comment nous allons corriger cela. Vous pouvez également vous abonner pour être prévenu lorsque le produit sera sorti.
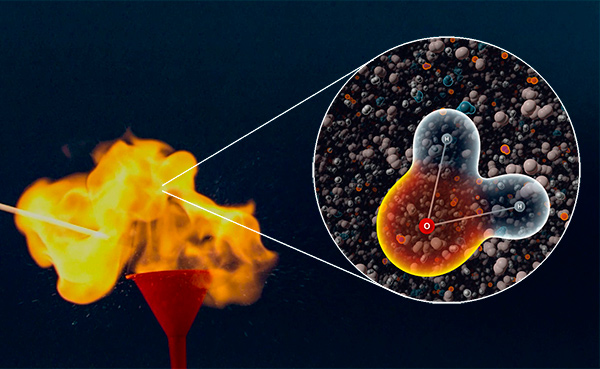
Les secrets de la combustion de l'hydrogène
Nous connaissons tous la formule chimique de l’eau : H2O. La plupart d’entre nous sauront écrire l'équation de la réaction de formation de l'eau : 2H2 + O2 = 2H2O. Mais seulement quelques personnes sur million sauront expliquer comment cette réaction se produit en réalité. Voici une vidéo qui explique tout.
Les analgésiques préviennent ils du vieillissement ?
Un récent article paru dans PLoS Genetics démontre que l'ibuprofène, couramment utilisé comme médicament anti-inflammatoire, contribue à améliorer la longévité. Comment ça marche ? Pour comprendre le mécanisme de l'action de l’ibuprofène nous avons besoin d'en savoir un peu plus sur les mécanismes du vieillissement.