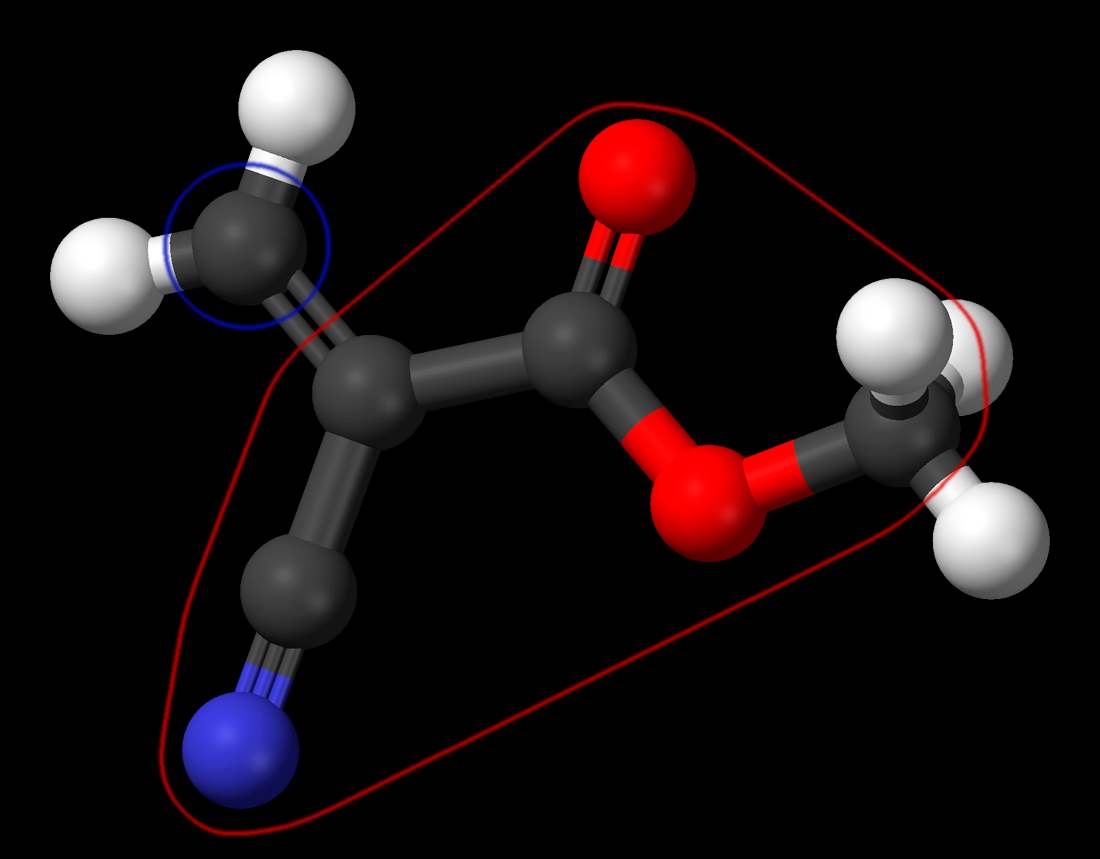
Humo sin fuego en un microscopio virtual con ampliación 100 000 000x
Sobre un viejo truco químico de cómo mover el humo de una esquina de la habitación a otra. Desvelaremos el secreto y explicaremos qué reacción química hay detrás de este truco a nivel molecular utilizando un microscopio virtual con ampliación 100 000 000x. Y por último, expondremos nuestros pensamientos de por qué hemos elegido este experimento de química para nuestro primer video.
Existe un viejo truco químico: soplar el humo de un cigarrillo en un vaso y darle la vuelta para que esté boca abajo. Al mismo tiempo, al darle la vuelta al otro vaso en la esquina opuesta de la habitación, el humo se desplazará desde el primer vaso a través de la habitación y aparecerá en el segundo vaso. He intentado hacerlo este fin de semana y pasé una buena media hora tosiendo después de una sola calada. ¿Pero cómo es posible que fuméis? ;)

¿Cuál es el secreto detrás de este truco?
Analicemos este truco. El humo no viaja de manera mágica a ninguna parte. El hecho es que mientras que el humo del cigarrillo entra en el primer vaso, en el otro vaso se forma humo nuevo. Aquí tenemos dos gases: el cloruro de hidrógeno (el gas que al disolverse en agua produce ácido clorhídrico) y el amoníaco (es a lo huelen los vagabundos). Cuando estos dos gases se mezclan, producen un material sólido llamado cloruro de amonio, cuyas partículas son visibles en forma de humo. Como habrás adivinado, esto es exactamente lo que sucedió en el segundo vaso: el interior del vaso estaba cubierto de una solución de agua concentrada de cloruro de hidrógeno (ácido clorhídrico), y la mesa en la que se colocó el vaso boca abajo fue pulverizada con una solución concentrada de amoniaco. Cuando el vaso fue colocado en la mesa, los vapores de los dos gases comenzaron a mezclarse y generaron humo.

Pues en esto consiste el truco. Existen muchas maneras de utilizar el efecto de humo producido por estos dos líquidos cuando se colocan lo suficientemente cerca el uno del otro. Por ejemplo, esto sería de lo más simple: toma dos bastoncillos de algodón, moja cada uno en el líquido correspondiente y observa cómo se genera el efecto de humo al juntarlos. También puedes tomar dos pipas de fumar e impresionar al público mostrándoles el flujo de humo de una pipa a la otra.
Pero ¿por qué hemos elegido este experimento para nuestro primer video?
En principio, fui tonto al pensar que debíamos empezar con la combustión del hidrógeno. Pensé que sería la reacción química más simple: ¿qué puede ser más primitivo que el compuesto de oxígeno y el elemento más básico, o sea, el hidrógeno? ¡Qué tonto e ingenuo era! Mi razonamiento era el siguiente: una molécula de O2 se acerca a una molécula H2, estas dos chocan, y si la velocidad de impacto es superior a un determinado umbral (es decir, el gas es lo suficientemente caliente), entonces los átomos se combinarían de la forma más eficiente en términos de ahorro de energía para formar una molécula de H2O. Pero resulta que esta reacción no es tan simple como parecía inicialmente. El químico ruso Nikolay Semenov y el fisicoquímico inglés Cyril Norman Hinshelwood recibieron conjuntamente el Premio Nobel de Química en 1956 por sus investigaciones en el mecanismo de estas reacciones químicas.
Entonces empecé a considerar las reacciones en soluciones que producen precipitaciones. Las reacciones a base de agua también eran complicadas. Los iones en agua no se mueven como partículas libres, sino como estructuras complejas compuestas de un ion de moléculas de agua fuertemente unidas a él y llamadas esferas de solvatación. Solamente este hecho demuestra que las reacciones en soluciones no son tan primitivas como parecen. Por no hablar de muy bonitas, pero complejas reacciones en los límites de fase, sobre todo con un catalizador como este o esta reacción.
Queríamos empezar con algo sencillo, así que pensamos en muchas reacciones químicas y al final elegimos esta. Hemos pensado que la generación de humo durante una reacción de cloruro de hidrógeno y amoníaco fue una de los más fáciles de entender y visualizar.
Nuestro primer video
Hay muchos vídeos buenos sobre la microbiología. Vídeos que muestran los procesos desde el interior. Aquí hay varios ejemplos: la traducción del ARNm, la replicación del ADN, de ADN a proteínas o cómo se empaqueta el ADN.
Pero en la química inorgánica apenas hay vídeos de este tipo. Me refiero no solo a los vídeos que muestran un hermoso experimento, sino también lo que sucede en el interior a nivel molecular. Ahora hay por lo menos un vídeo de estas características ;) Y espero que pronto los habrá más.
Así que imaginemos que tenemos un microscopio que permite la ampliación de 100 000 000x. Es el aumento que necesitamos ver los átomos por separado. Así que tomemos el microscopio y echemos un vistazo más de cerca:
Esta fue la primera vez que estuve llevando a cabo experimentos con mis hijos durante un fin de semana y conseguí mostrarles lo que realmente estaba pasando en el interior. Esto ayuda a entender la química mejor que cualquier fórmula. Suscríbete a nuestras actualizaciones y síguenos en Twitter para aprender sobre los nuevos experimentos químicos con nuestro microscopio virtual.
Problema extra
Y aquí viene nuestro problema extra de hoy: encuentra los errores en este video. Hemos cometido varios: algunos por razones artísticas y otros por la falta de tiempo. ¿Puedes encontrarlos? Tuitéanos tu respuesta.
Ver también

Juego de química experimental como suscripción
Por fin estamos en disposición de contaros el aspecto que tendrá nuestro primer producto. Será un juego de química experimental, para nada tradicional, que podréis usar en vuestros hogares. A continuación, podréis leer qué tres problemas hemos detectado en los juegos de química existentes, y cómo los hemos solucionado en nuestro juego. También podréis suscribiros para recibir una notificación cuando hayamos distribuido nuestro producto.
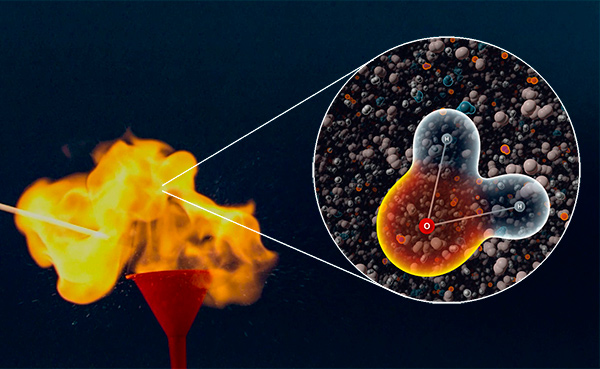
Secretos de la combustión de hidrógeno
Todos conocemos la fórmula química del agua: H2O. La mayoría pueden escribir la ecuación de la reacción en la que se obtiene el agua: 2H2 + O2 = 2H2O.
Pero solo unos pocos pueden explicar cómo se produce esta reacción en realidad. Vea el vídeo en el que se explica todo.