Разбор ошибок в нашем предыдущем видео + задача о переваривании пищи
Прошла неделя с тех пор, как мы выложили первое видео. В конце предыдущего поста была поставлена задача найти в ролике ошибки. Сегодня мы постараемся разобрать, какие ошибки были совершены. Они были частично преднамеренными, чтобы сделать видео “красивым”. То, на что многие химики указывали как на ошибки, не всегда было неверным: истина настолько парадоксальна, что многие были не готовы в нее поверить. А самой серъезной нашей ошибкой была педагогическая. Заодно покажем, каким способом в современной химии выясняют, как на самом деле происходят реакции и устроены молекулы.
Напомним, о чем был ролик. Мы показали химическую реакцию образования дыма при подносе соляной кислоты и раствора аммиака. Показали не только “снаружи”:

но и “изнутри”: как летают молекулы, взаимодействуюя между собой, как начинается зарождение кристаллов:

Давайте начнем с простых ошибок и постепенно будем увеличивать сложность.
Ошибка №1: Слишком большое везение
Мы намеренно увеличили вероятность нужных нам столкновений. Если посмотреть на 65 секунде:
тут одна за другой сталкиваются молекулы хлороводорода (HCl) и аммиака (NH3). Учтите, что при съемке время замедленно более, чем в триллион раз. Иначе молекулы бы носились мимо экрана, как угорелые и мы бы ничего не увидели. Вероятность увидеть столкновения нескольких молекул за столь малое время, меньше, чем вероятность выиграть в национальную лотерею 10 раз подряд. А еще посмотрите, как они летят друг на друга :) Как буд-то специально, чтобы столкнуться. В реальной жизни так не бывает.
Но это художественная ошибка. Мы специально это сделали. Чтобы показать, как на самом деле все происходит, при такой замедленной съемке пришлось бы наблюдать годами, чтобы увидеть несколько нужных нам столкновений. Помните, видео замедленно более чем в триллион раз! Настолько, что если вы будете смотреть на него всю свою жизнь (давайте надеяться, что вы доживете до 150 лет), то в реакции на самом деле не пройдет и тысячной доли секунды. А если время не замедлить, то молекулы будут летать так быстро, что ничего не будет видно.
У нашего программиста Михаила есть специальный регулятор “везения”. Этот регулятор увеличивает вероятность нужных нам событий, чтобы было «красиво». И это касается не только столкновения молекул, которые магическим образом попадают друг в друга ровно так, как надо, но и маленьких кристалликов, которые так удачно по очереди друг в друга врезаются.
С немного похожей проблемой столкнулись создатели видео Inner Life Of A Cell. Им пришлось жертвовать аккуратностью в угоду визуальной красоты и разрежать содержимое клетки на 90-95%, так как в реальности там все очень-очень плотно.
Ошибка №2: Схематичность процесса
Еще одно художественное допущение: в видео все стадии образования кристалликов хлорида аммония идут последовательно. Вот столкнулись молекулы хлороводорода (HCl) и аммиака (NH3). Вот несколько HCl-NH3 столкнулись между собой и начали образовывать маленький комплекс. Вот несколько маленьких комплексов столкнулись между собой. В реальности все это происходит параллельно в намного более хаотичном режиме.
Ошибка №3: Изменение структуры хлорида аммония при кристаллизации
При взаимодействии хлороводорода (HCl) и аммиака (NH3) образуется молекула ClH-NH3. Многие химики сказали, что мы неправильно показали структуру этой молекулы. Что на самом деле один водород отбирается азотом с хлора и правильная структуры этой молекулы Cl-NH4. Они привыкли, что в водном растворе хлорид аммония существует именно в таком виде. Но они не правы. Да, в водном растворе или в кристалле одно ядро водорода переносится на азот. А в газе нет. В газе все так, как мы показали.
Откуда мы можем это знать? Как вообще, химики могут узнать, какую структуру имеет та или иная молекула? Ведь не существует микроскопов, позволяющих “посмотреть” на нее и увидеть ее структуру. Я буквально в двух словах, очень грубо, опишу два способа, позволяющих это выяснить.
Экспериментальный
Существует ряд экспериментальных способов, которыми можно кое-что выяснить о структуре молекулы: например различные спектры излучения или поглощения электромагнитного излучения скажут нам, какую структуру может иметь молекула.
Теоретический
На самом деле мы знаем все необходимые фундаментальные законы, описывающие строение молекул. Это законы квантовой физики. Мы можем просто написать уравнение Шредингера для всей молекулы. Его решение и опишет строение молекулы. Осталось только его решить ;) А это очень непросто. Но возможно. Существуют алгоритмы, позволяющие найти численное решение уравнения Шредингера для достаточно больших молекул. Такой подход называется ab initio. Мы можем провести эти расчеты достаточно точно и не сомневаться, что получили правильный ответ. Есть много программ, которые умеют делать такие квантово-химические расчеты. Еще 50 лет назад это казалось несбыточной мечтой, а сегодня вы у себя дома, на своем компьютере, можете рассчитывать строение достаточно сложных молекул.
Но давайте вернемся к нашему случаю. Мы проверяли структуры молекул квантово-химическими ab initio расчетами. Есть хорошая статья, в деталях разбирающая механизм переноса ядра водорода в этой реакции. Ее вывод: без молекул воды переноса нет. То есть, нет здесь и ошибки.
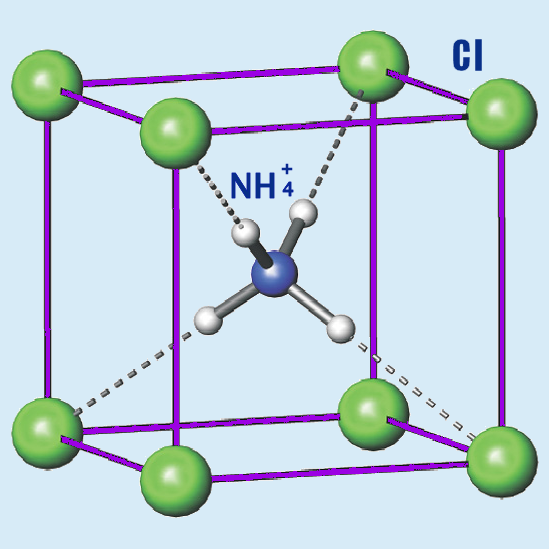
А закралась она совсем в другом месте. В педагогическом. Дело в том, что когда отдельные молекулы собираются в кристалл, то в кристалле случается тот самый перенос. В кристалле хлорид аммония NH4 со всех сторон окружен атомами хлора:
Но перенос случается только внутри кристалла. В наружном слое водород все еще рядом с хлором, азот еще не “отобрал” его у хлора, как это происходит внутри. И мы даже это показываем:
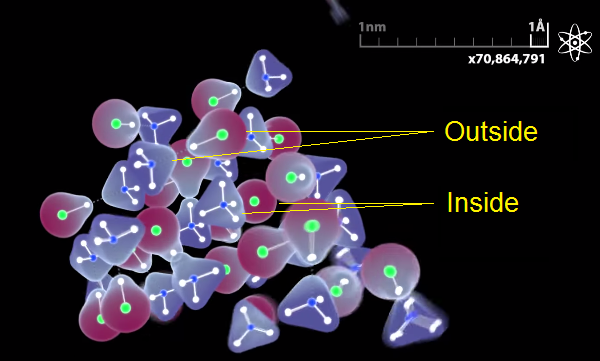
Тут, правда, мы совершили ошибку, и не подчеркнули достаточно этот момент. У нас такие маленькие кристаллики, что почти все атомы в этом таком кристалле снаружи, на внешнем слое. Поэтому этот важный процесс, который происходит только внутри кристалла почти не виден. Получается, что показывая правильную картинку мы невольно вводим людей в заблуждение. Они могут ошибочно подумать, что и весь кристалл состоит из “кусочков” HCl и NH3, а это не так. Это только в самом верхнем слое. В этом, пожалуй, самая большая ошибка нашего видео. Мы постараемся исправить видео, чтобы подчеркнуть этот факт.
Прочее
Есть один тонкий момент: если в воздухе достаточно паров воды, то, возможно, в реакции помимо молекул хлороводорода (HCl) и аммиака (NH3) будут участвовать молекулы воды (H2O). Мы постараемся провести эксперимент с абсолютно сухими газами, чтобы проверить является ли наличие паров воды существенным для этой реакции.
Задача
А задача сегодня - о не раз уже упомянутом сегодня хлороводороде (HCl). Раствор хлороводорода в воде называется соляной кислотой. Как вы возможно знаете, именно эту кислоту выделяет наш желудок. Вопрос будет следующий: если в раствор соляной кислоты, как в нашем желудке, положить кусочки мяса, хлеба и яблока, что с ними произойдет через день? Что быстрее разложится?
Я начинаю этот эксперимент:

В следующий раз покажу, что получилось с этой едой через сутки. Думаю, результат вас удивит. А у вас какие мысли?
Читайте также

Вакансия – Mobile developer/product manager
Работа мечты для программиста, которому интересна мобильная разработка (iOS/Android): атмосфера стартапа (но уже без рисков и с высокой зарплатой), интересный перспективный проект с нуля с крутыми технологиями, работа на международный рынок. Задумайтесь: вы будете не просто писать очередную игру, а делать мир лучше! Такие возможности встречаются очень редко, и для вас это, возможно, станет выходом на новый виток.

Вакансия - fullstack web-developer
Привет! Мы в [MEL Science](https://melscience.com/en/v2/) ищем человека в команду, занятую всем, что связано с вебом и бизнесом: от фронтенд-оптимизаций до автоматизации полиграфии на бекенде.

Вакансия – in-house recruiter
Наши продажи активно растут (более 500% в год), растет и наша команда. Мы ищем специалиста по подбору персонала — того, кто будет заниматься поиском кадров. Успех всего бизнеса зависит от людей. Поэтому человек, организующий процесс поиска, — ключевая должность в компании.
Мы ищем очень специфичных людей, сочетающих в себе любовь к науке с умениями в своей сфере (программировать для программиста, рисовать для дизайнера и т.д.). Найти таких людей непросто, их очень мало, поэтому на некоторые вакансии мы перебираем сотни кандидатов на стадии резюме.